Warum sich Zika- und Dengue-Viren bevorzugt durch Blut übertragen
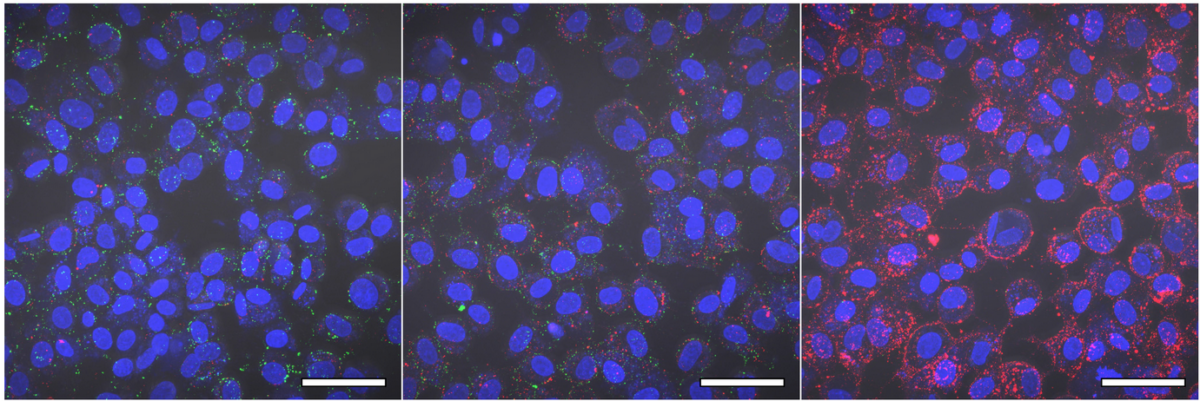
Anheftung von Zika-Viruspartikeln (grün) und extrazellulären Vesikeln aus Samenflüssigkeit (rot) an Zielzellen (Zellkerne in blau). Bei geringen Vesikel-Konzentrationen (links) können sich Viren problemlos an die Zelle anheften und diese infizieren, bei steigender Konzentration der Vesikel wird der Zugang der Viren zu den Bindestellen jedoch zunehmend verhindert und eine Infektion unterbunden. Skala = 20 μM. Foto Rüdiger Groß
26.03.2024 | Im Wortlaut. Warum erfolgt die Infektion mit dem Zika-Virus und anderen Krankheitserregern eher durch Insektenstiche als über Speichel oder Sperma, obwohl das Virus darin vorkommt? Eine internationale Forschungsgruppe unter Leitung der Universitäten in Marburg und Ulm hat den Mechanismus aufgeklärt, der die Viren in den genannten Körperflüssigkeiten blockiert. Das Team berichtet im Fachblatt „Nature Microbiology“ über seine Ergebnisse.
Verbreitung von Zika- und Ebolavirus
Das Zika-Virus ist vor allem in Südamerika, Afrika und Südostasien verbreitet. Es verursacht Fieber sowie Ausschlag und Gelenkschmerzen, kann bei der Infektion von Schwangeren aber auch Schädigungen an Föten hervorrufen. Das Virus wird normalerweise durch Stechmücken übertragen. „Die Übertragung erfolgt sehr selten auf oralem oder sexuellem Weg, obwohl das Virus in Körperflüssigkeiten wie Speichel und Sperma vorhanden ist“, erklärt der Marburger Virologe Professor Dr. Janis Müller, der Leitautor des Fachaufsatzes.
Woran liegt es, dass manche Virus-belastete Körperflüssigkeiten selten zur Infektion führen? Wie Müllers Arbeitsgruppe herausfand, sind dafür Membranbläschen, so genannte extrazelluläre Vesikel verantwortlich, die auch in Speichel und Sperma vorkommen. Bislang wusste man aber weder, auf welche Weise diese Vesikel die Virusinfektion verhindern, noch für welche weiteren Viren das gilt.
Das Team um Janis Müller tat sich mit Wissenschaftlerinnen und Wissenschaftlern aus der ganzen Bundesrepublik, Europa und den USA zusammen, um das Rätsel zu lösen. Die Forschungsgruppe fand heraus, dass die virenhemmende Wirkung auf einem bestimmten Molekül beruht, nämlich auf dem Fettmolekül Phosphatidylserin, das die Vesikel auf ihrer Oberfläche tragen.
Körpereigener Abwehrmechanismus gegen Zika- und Ebolavirus identifiziert
Das Gegenstück dieses Moleküls auf den Körperzellen – ein Phosphatidylserin-Rezeptor – hilft Zika-Viren normalerweise bei der Infektion. An diese Rezeptoren docken die Viren an, um in die Zellen einzudringen. „Die Vesikel verhindern dies, da sie sich ebenso an diese Rezeptoren anheften“, wie Dr. Rüdiger Groß von der Universität Ulm, Erstautor der Studie, ausführt: „Extrazelluläre Vesikel, welche Phosphatidylserin auf ihrer Außenseite tragen, konkurrieren mit den Viren um die Eintrittspforte – und sie sind in über 10.000-fach größeren Mengen vorhanden als Viruspartikel.“ Die Folge: Die Zika-Viren finden keinen Weg in die Körperzellen.
„Damit haben wir einen völlig neuartigen körpereigenen Abwehrmechanismus identifiziert“, betont Müller. Das Forschungsteam überprüfte, ob die Vesikel unter Laborbedingungen auch weitere Viren mit ähnlichen Eintrittsmechanismen an der Infektion hindern. Tatsächlich trifft das auf Ebola- und Dengue-Viren sowie weitere Erreger zu, aber nicht auf HIV-1, SARS-CoV-2 und Herpesviren – diese nutzen andersartige Eingangspforten.
„Der neu entdeckte Mechanismus erklärt auch, warum die Übertragung von Zika- und Dengueviren durch blutsaugende Insekten wahrscheinlicher ist“, legt Müller dar: „Das Blut enthält nämlich kaum Phosphatidylserin-exponierende Vesikel.“
Dr. Janis Müller hat eine Qualifikationsprofessur an der Philipps-Universität inne und leitet eine Arbeitsgruppe am Marburger Institut für Virologie. Dr. Rüdiger Groß arbeitet als Juniorgruppenleiter am Institut für Molekulare Virologie des Universitätsklinikums Ulm. Daneben beteiligten sich Wissenschaftlerinnen und Wissenschaftler aus Göttingen, Heidelberg, Berlin sowie aus Schweden, Großbritannien und den USA an der Studie. Die Deutsche Forschungsgemeinschaft, der Europäische Forschungsrat, das Bundesforschungsministerium, das Niedersächsische Wissenschaftsministerium und die Carl-Zeiss-Stiftung förderten die Forschungsarbeit finanziell.
Originalveröffentlichung: Rüdiger Groß & al.: Phosphatidylserine-exposing extracellular vesicles in body fluids are an innate defense against apoptotic mimicry viral pathogens, Nature Microbiology 2024, URL: https://www.nature.com/articles/s41564-024-01637-6
Zugunsten der besseren Lesbarkeit wurden Absätze und Zwischenüberschriften eingefügt.












